Den eukaryote cellesyklusen: et ikke-reduserbart sammensatt system
Av Jonathan McLatchie, 26. november 2024. Oversatt herfra
Jeg har tidligere publisert flere artikler på Evolution News om det utrolige designet, og utsøkte ingeniørvitenskap -lenke, av den eukaryotiske celledivisjonssyklusen. Jeg har også nylig publisert en artikkel, i tidsskriftet Bio-Complexity -lenke, der jeg dokumenterte betydelige hindringer for opprinnelsen til den eukaryote cellesyklusen ved evolusjonsprosesser. (1) Her vil jeg beskrive flere aspekter av cellesyklusen Det gjør den ikke-reduserbart komplisert, som også blir diskutert i artikkelen min.
 Kondensiner
Kondensiner
Kondensiner er proteinkomplekser som spiller en avgjørende rolle i organisasjonen og segregeringen av kromosomer under celledeling. De er sterkt bevart over eukaryoter. Kondensin I er aktiv under sen profase og bidrar til den strukturelle integriteten til kromosomer etter nedbrytningen av kjerne-konvolutten. Kondensin II fungerer tidligere i Profasen og er involvert i de innledende stadiene av kromosomkondensasjon i kjernen.
Bilde 1. Kondensin-skjematisk. Bildekilde: Wikimedia Commons.
Kondensinmolekyler er sammensatt av fem underenheter (som vist på figuren), inkludert SVK (Strukturell Vedlikehold av Kromosomer) proteiner SVK2 og SVK4, som har ATPase -aktivitet. SVK-proteiner har kveiledomener (lange, fleksible armer som brettes tilbake på seg selv, og skaper en V-formet struktur), et hengseldomene som letter dimeriseringen av de to SMC-proteinene; og hodedomener som inneholder ATP-binding og ATPase-steder, og gir energi til aktivitetene i kondensiner. I tillegg til SVK-underenhetene, er det også tre ikke-SVK-underenheter, som binder spesifikke regioner med DNA og hjelper til med regulering av kondenseringsaktivitet.
Kondensinkomplekser belastes på kromatin på en trinnvis måte, regissert av ikke-SVK-underenheter. SVK-underenhetene lager løkker i DNA, og bruker deres ATPase -aktivitet. Disse løkkene er stabilisert og kondensert til mitotiske kromosomer.
Kondenserende proteiner er avgjørende for prosessen med celledeling. I deres fravær vil konsekvensen være kromosomal uorganisering, samt store vanskeligheter med å oppnå riktig segregering under mitose.
Kinetokorer
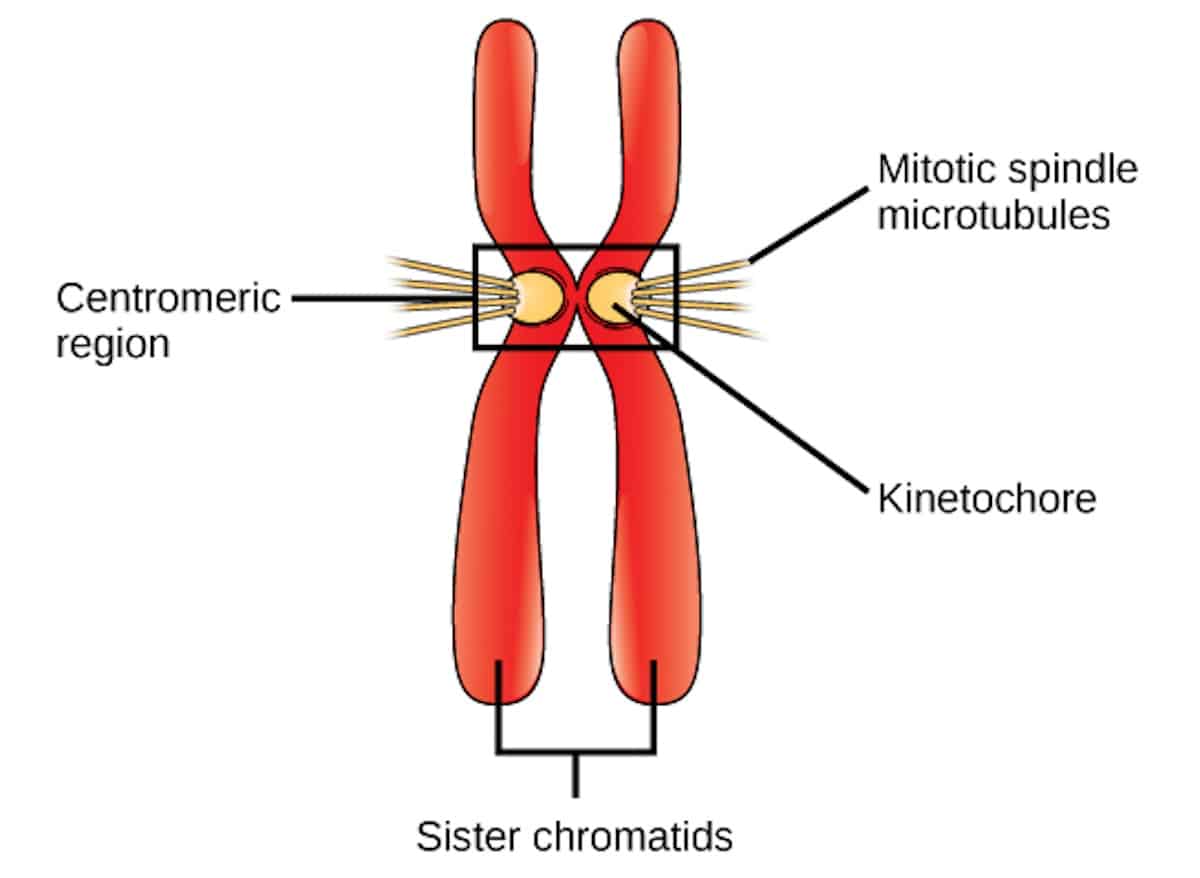 Bilde 2. Kromosompar -m. forklaring
Bilde 2. Kromosompar -m. forklaring
Kredit: CNX OpenStax, CC BY 4.0 https://creativecommons.org/licenses/by/4.0, via Wikimedia Commons.K
Et kompleks av proteiner, kjent som Kinetokoren, samler seg rundt sentromeren til hvert kromosom (som vist på Bilde 2), og er avgjørende for prosessen med mitose celledeling. Hver kinetokore fungerer som et festested for spindelmikrotubulen, som stråler ut fra sentrosomene ved cellens poler. Kinetokorer hjelper til med innretting av kromosomer ved ekvatorialplanet til cellen under metafase, noe som sikrer lik fordeling av genetisk materiale. Kinetochores føler også spenning generert av mikrotubul-utstrekking, og sikrer dermed riktig tilknytning. Hvis feil tilknytning oppstår (f.eks. hvis kinetokorene til begge søsterkromatider er festet til den samme polen), kan disse feilene korrigeres av det kinetokor-assosierte maskineriet.
Hva ville være konsekvensen hvis det ikke var noen kinetokorer? Dette ville resultere i feil festing av kromosomene til spindelapparatet, og det genetiske materialet ville være ulikt fordelt på dattercellene. Faktisk er kinetokorer så kritiske for prosessen med celledeling at de blir funnet allestedsnærværende gjennom alle kjente eukaryote organismer.
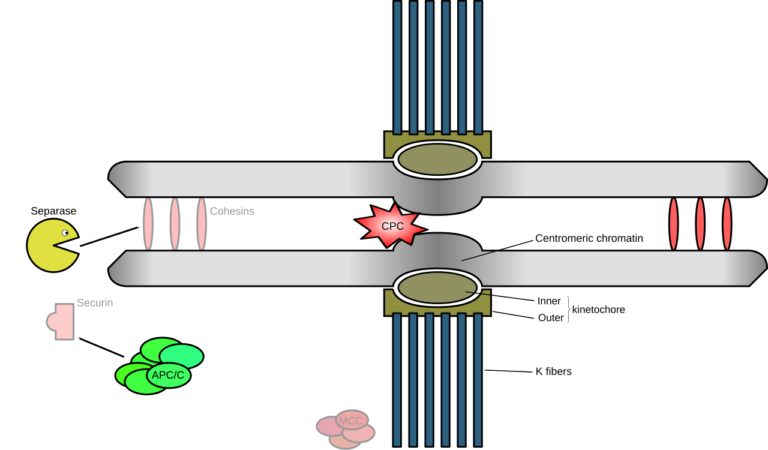 Det Separase og Anafase promoterende komplekset
Det Separase og Anafase promoterende komplekset
Bilde 3. Spindel-montasje-m. sjekkpunkter-tillnyttet
Progresjon fra metafase til anafase er mediert av at anafasen promoterer kompleks eller syklosom (APC/C), en E3 ubiquitin ligase (grønne, ellipseformede på Bilde 3). Når APC/C er bundet til sin koaktivering, CDC20, fungerer APC/C for å formere securin (et protein som forhindrer spaltning av kohesin ved enzym-frigjøring). Formering av securin merker det for ødeleggelse, av cellens molekylære makulerer, proteasomet. Dette frigjør enzymet (separase), for å spalte kohesinringen, som tetter søsterkromatider sammen, og dermed fremme søsterkromatid-separasjon.
Bilde 3. Spindel-motasje v. celledeling (mitose)
I fravær av Separase ville ikke søsterkromatider skille seg, og cellen ville bli ute av stand til å segregere kromosomene ved anafase. Faktisk har eksperimentelle knockout-studier vist at sletting av separase resulterer i embryonal dødelighet. (2,3) Cellesyklusprogresjon vil også bli stoppet i fravær av APC/C, og hemme progresjonen fra metafase til anafase. Eksperimentelle studier som slo ut APC2 (en kjerne APC/C -underenhet) hos mus, resulterte, for eksempel, i dødelig benmarg-svikt i løpet av bare syv dager. (4)
Aurora kinaser
 Aurora -kinaser er også avgjørende for riktig spindeldannelse og kromosomsegregering. Aurora kinase A fosforylerer proteiner involvert i mikrotubulusorganisasjon og letter nøyaktig tilknytning av mikrotubuli til kinetokorer. Faktisk, "Uten Aurora A, dør mus tidlig under embryonal utvikling i løpet av 16-cellestadiet. Disse embryoene uten Aurora A, har defekter i mitose, spesielt i spindelmontering, som støtter kritiske funksjoner av Aurora A under mitote overganger." (5) Dette indikerer at Aurora kinase A er blant komponentene som er essensielle for vellykket celledeling.
Aurora -kinaser er også avgjørende for riktig spindeldannelse og kromosomsegregering. Aurora kinase A fosforylerer proteiner involvert i mikrotubulusorganisasjon og letter nøyaktig tilknytning av mikrotubuli til kinetokorer. Faktisk, "Uten Aurora A, dør mus tidlig under embryonal utvikling i løpet av 16-cellestadiet. Disse embryoene uten Aurora A, har defekter i mitose, spesielt i spindelmontering, som støtter kritiske funksjoner av Aurora A under mitote overganger." (5) Dette indikerer at Aurora kinase A er blant komponentene som er essensielle for vellykket celledeling.
Bile 4. Mikrotubuler -stråler ut fra centrosom
Mikrotubuler
Jeg har tidligere beskrevet den kritiske rollen til mikrotubuler i celledeling. Mikrotubuli stråler fra centrosomer og ankrer seg til kinetokore-komplekset, samlet rundt centromerer i hvert kromosom. Under metafase er kromosomene justert langs ekvatorialplanet til cellen, bundet til mikrotubuler ved kinetokoren. I anafase trekkes søsterkromatidene fra hverandre av mikrotubulene, drevet av Polward -spindelkrefter. Mikrotubulene er derfor viktige for å adskille søsterkromatidene inn i de to dattercellene.
I mangel av mikrotubuler, ville mitotisk spindelenhet dermed være sterkt nedsatt, og hemme kromosomjustering og segregering. Eksperimentelle studier med musembryoer som mangler y-tubulin, utøver en mitotse fengsling, som stanser utvikling i morula/blastocyst stadiene.(6)
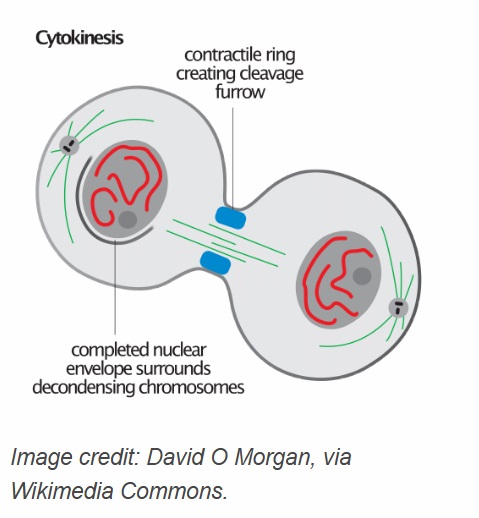
Den kontraktile ringen
Bilde 5. Cytokinese. Kreditt: David O Morgan, via Wikimedia Commons.
Den kontraktile ringen er også kritisk for prosessen med cytokinese, det siste stadiet av mitose der cellen fysisk deler seg inn i to datterceller. Det er hovedsakelig sammensatt av aktinfilamenter og myosin II motoriske proteiner, sammen med andre regulatoriske proteiner som forminer, RHOA og septiner. Disse komponentene danner en dynamisk, belte-lignende struktur under membranen ved ekvator i den delende cellen. Den kontraktile ringen produserer kraften som er nødvendig for inntrenging av spaltningsfuruen. Myosin II -proteiner interagerer med aktinfilamenter i ringen for å generere denne kontraktile kraften. Denne prosessen blir energisk ved hydrolyse av ATP. Når ringen strammes, klemmer plasmamembranen innover, og deler til slutt cytoplasmaen. Fraværet av den kontraktile ringen ville resultere i en mangel i cellen til å dele seg, noe som fører til tokjernede celler, så vel som andre abnormaliteter.
Motorproteiner
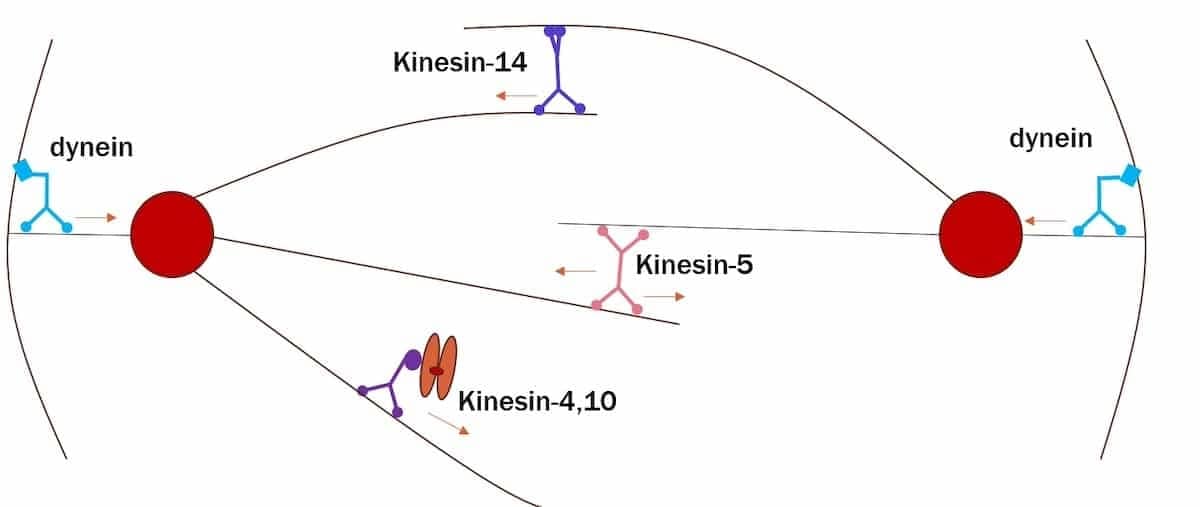 Bilde 6. Kinesin-wikpedia
Bilde 6. Kinesin-wikpedia
I en tidligere artikkel på Evolution News beskrev jeg rollen til motorproteiner (kinesin og dynein) i monteringen og funksjonen til mitose-spindelen under eukaryotisk celledeling. Jeg vil henvise interesserte lesere til det essayet for en diskusjon om denne forbløffende prosessen. Fraværet av disse motorproteinene ville kompromittere transport og plassering av kromosomer alvorlig, noe som resulterte i kromosomal feiljustering under metafase og vanskeligheter med å etablere en riktig mitose-spindel. Konsekvensen ville bli feil i kromosomsegregering under anafase.
CDK og cyklinmolekyler
Jeg har tidligere skrevet om rollen til cyklinavhengige kinaser og cyklinmolekyler i cellesyklusprogresjon -lenke. Jeg henviser lesere der for en anmeldelse. CDK- og cyklinmolekylene viser redundans, noe som betyr at de ikke alle er individuelt nødvendige. For eksempel beholder muse-knockout av CDK2, 3, 4 eller 6 fortsatt levedyktighet. (7,8,9,10,11,12,13) Videre har gjærceller bare en enkelt CDK, spesielt CDK (1.14) Interessant, resulterer dobbelte knockout som involverer kombinasjoner av Cdk2 og 4, eller Cdk4 og 6, i embryonal dødelighet, selv om doble knockouts av Cdk2 og 6 ikke gjør det. (15,16) Det ser ut til at paret CDK2 og 4 og paret CDK4 og 6 kan erstatte hverandre. (17) Imidlertid ser CDK1 ut til å være essensiell, og å slå den ut stopper utviklingen på blastocyst-stadiet. (18)
CDK -molekyler aktiveres, selv ved binding av cyklinmolekyler. Uten disse cykliner ville CDK-ene være inaktive, noe som resulterte i cellesyklusstopp. Selv om det er redundans her også (og dermed ikke alle cykliner er uunnværlige for vellykket inndeling), vil fraværet av syklin B (som aktiverer CDK1 for å drive progresjon til mitose) svekke overgangen fra G2 til M-fasen. Med andre ord, vil cellen ikke kunne komme inn i mitose. Dette er bekreftet ved eksperimentelle knockout-studier av cyclin B i musembryoer, noe som fører til stopp av cellesyklusen i G2 etter så lite som to delinger. (19,20)
 Sjekkpunkter
Sjekkpunkter
Jeg har tidligere skrevet om de forskjellige cellesyklus sjekkpunktene - dvs. G1 (begrensning) sjekkpunkt, G2 (DNA-skade) sjekkpunkt og spindelmonterings-sjekkpunktet (se artiklene mine om disse her, her og her). Disse er også viktige for vellykket celledeling. For eksempel, uten det mitotiske sjekkpunkt-komplekset, ville cellens evne til å overvåke spindelenheten bli avskaffet - og drastisk øke risikoen for at celler går gjennom inndeling med spindeldefekter, resultatet av dette vil være kromosom -missegregering og aneuploidi. Fraværet av G1 -sjekkpunktet vil gjøre det mulig for skadet DNA å komme inn i S-fasen, noe som kan føre til utbredelse av mutasjoner så vel som genomisk ustabilitet. Tap av G2-sjekkpunktet vil tillate celler med DNA-skade å inngå mitose, noe som førte til deling av celler med uopprettet genetisk materiale, samt en sterkt økt risiko for kromosomavvik. Uten DNA-skadesjekkpunktet i S-fasen, ville replikering av skadet DNA forekomme, noe som resulterer i utbredelse av mutasjoner og dermed en forhøyet risiko for genetisk avvik i dattercellene.
Bilde 7. Sjekkpunkter -oversatt til maskin-styrt system (Kredit: O. Grasso)
Ikke-reduserbart sammensatt
Som det fremgår av den flyktige diskusjonen ovenfor, er forskjellige komponenter i det mitotiske celledelingsapparatet uunnværlige for at systemet skal fungere. Dette gjør den eukaryote celledelingen ikke-reduserbart kompleks, noe som gjør den motstandsdyktig mot forklaringer når det gjelder blinde evolusjonsprosesser. Ethvert system som oppnår et komplekst mål på høyere nivå, ved hjelp av forskjellige godt tilpassede samhandlende komponenter, krever framsyn å komme til. I en påfølgende artikkel vil jeg diskutere hvordan utfordringen til evolusjonsberetninger om opprinnelsen til eukaryotisk celledeling, strekker seg mye dypere enn dette.
For Referanser, se slutten av artikkelen her
Oversettelse, via google oversetter, og bilder ved Asbjørn E. Lund
 Kondensiner
Kondensiner Bilde 2. Kromosompar -m. forklaring
Bilde 2. Kromosompar -m. forklaring Det Separase og Anafase promoterende komplekset
Det Separase og Anafase promoterende komplekset Aurora -kinaser er også avgjørende for riktig spindeldannelse og kromosomsegregering. Aurora kinase A fosforylerer proteiner involvert i mikrotubulusorganisasjon og letter nøyaktig tilknytning av mikrotubuli til kinetokorer. Faktisk, "Uten Aurora A, dør mus tidlig under embryonal utvikling i løpet av 16-cellestadiet. Disse embryoene uten Aurora A, har defekter i mitose, spesielt i spindelmontering, som støtter kritiske funksjoner av Aurora A under mitote overganger." (5) Dette indikerer at Aurora kinase A er blant komponentene som er essensielle for vellykket celledeling.
Aurora -kinaser er også avgjørende for riktig spindeldannelse og kromosomsegregering. Aurora kinase A fosforylerer proteiner involvert i mikrotubulusorganisasjon og letter nøyaktig tilknytning av mikrotubuli til kinetokorer. Faktisk, "Uten Aurora A, dør mus tidlig under embryonal utvikling i løpet av 16-cellestadiet. Disse embryoene uten Aurora A, har defekter i mitose, spesielt i spindelmontering, som støtter kritiske funksjoner av Aurora A under mitote overganger." (5) Dette indikerer at Aurora kinase A er blant komponentene som er essensielle for vellykket celledeling.
 Bilde 6. Kinesin-wikpedia
Bilde 6. Kinesin-wikpedia Sjekkpunkter
Sjekkpunkter